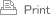Arctic Circle はじめに
 Kees Polderman, MD, PhD,
University Medical Center Utrecht, Utrecht, Netherlands
Kees Polderman, MD, PhD,
University Medical Center Utrecht, Utrecht, Netherlands
低体温療法の導入期では、目標体温(通例32~34℃)にできるだけ早く、しかもできるだけ副作用を伴わず達することが必要です。このことは、心拍再開か ら最高8時間が経過し、低体温療法が保留されない限り、できるだけ早くcoolingが始められなければならないことを意味しています。
新しいcooling機器の多くは急速な冷却能力を持っています。体表を効率的にcoolingする機器と高流量かつ急速な冷たい輸液が併用されれば、 4℃/hrのcooling rateを達成することができます。中枢温の“オーバーシュート(すなわち、目標体温よりも有意に低い体温にまで低下する)”を防ぐため、中枢温が正しく 測定されることが重要で、体温測定に選ばれた部位ができるだけ“真の中枢温”を反映している必要があります。“真の中枢温”として一般に認められている gold standardは、肺動脈カテーテルで測定される血液温です。
他の部位で測定される体温は、このgold standardと比較される必要があります。この点に関して、現在使われている体温測定部位及び測定方法には、共通する問題と固有の限界があるということを理解していなければなりません。患者さんの中枢温に急激な変化が見られる場合、gold standardである血液温と臨床でしばしば使われる測定部位(食道、膀胱、直腸、鼓膜)で得られる温度との間で、substantial time lags(大きな時間的な遅れ)が発生することがあります。cooling速度が早いほど、測定体温と実際の中枢温との間のtime lag(時間的な遅れ)が大きくなります。この現象は、体温のオーバーシュート(=希望の体温よりも低下する)の危険性とも大きな関係があります。測定体温には、実際の体温とは常に時間的な遅れがあります。体温が既に目標体温になっていても、その事実が体温プローブを制御している機器に正しく“インプット”されないため、cooling機器は患者さんをcoolingし続けます。cooling機器は、測定温のインプットが設定目標体温に近づくまでcoolingを続けます。この間、実際の中枢温(=血液での測定体温)は、目標体温レンジから有意に低下することがあります。
体温測定におけるこの遅れには、いくつかの理由があります。第一は、体温が低下した場合、体の様々な部位や臓器で同じ体温になるには時間がかかるということです。体温が平衡に達する速度は、臓器血流に左右されます。臓器への血液循環は、ショックや低体温といった一般的なファクタと共に、臓器固有のファクタによっても影響を受けます。また使用しているcooling機器によっても、体温測定値に影響が見られます。
現在使われている殆どの中枢温測定プローブは、体温の急速な変化を検出できるようには作られていません。むしろ(通常は長い時間をかけて起こる)小さな体 温変化をできるだけ正確に反映するようになっています。このため、これらのプローブでは、変化した体温と同じになり、機器に変化した体温をインプットする には、ある程度の時間がかかります。
この問題は、他の要因と複合して作用します。例えば、最もよく使われている膀胱温プローブ(Tyco Healthcare社製フォーリーカテーテル)は浮動する温度プローブで、カテーテル内に埋め込まれていません。このため、プローブがカテーテル内を前 後に動き、膀胱を塞ぐバルーン(生食が充填される)内に入る可能性があります。バルーンに室温の生理食塩水が充填されたばかりであった場合、温度測定に有 意な影響を与えます。勿論、時間が経てばバルーン内の生理食塩水は膀胱温に達します。温度が平衡状態になるまでには時間がかかり、その間は体温測定にエ ラーが見られ、cooling時に問題を起こします。
(この場合、温度センサが生理食塩水で満たされたバルーン内に入ったことによって、体温が過小評価さ れ、冷却速度がかなり遅くなります。)
現在、最もよく使われる温度測定部位には、それぞれの利点と問題があります。様々な中枢温測定部位と血液温との平均的な時間的な遅れ、及び様々な中枢温測定部位の利点と限界については、追加の一覧にまとめています。
低体温の副作用のリスク、特に不整脈のリスクは、患者さんの中枢温が30℃以下に低下した場合に有意に上昇します。中枢温の測定エラー(=測定遅れ)によって起きたオーバーシュートは、重篤な結果をもたらします。低体温療法をしている、あるいは急速なcore coolingをしようとしている医師は、さまざまな測定部位及び測定方法の限界について知っており、30℃以下に体温が低下しないように適切な注意を払わなければなりません。
Arctic Circle 『体温測定部位について:テクニカルな及び測定における諸問題(1)』
Kees Polderman, MD, PhD, University Medical Center Utrecht, Utrecht, Netherlands
 低体温療法の導入期では、目標体温(通例32~34℃)にできるだけ早く、しかもできるだけ副作用を伴わず達することが必要です。このことは、心拍再開か ら最高8時間が経過し、低体温療法が保留されない限り、できるだけ早くcoolingが始められなければならないことを意味しています。
低体温療法の導入期では、目標体温(通例32~34℃)にできるだけ早く、しかもできるだけ副作用を伴わず達することが必要です。このことは、心拍再開か ら最高8時間が経過し、低体温療法が保留されない限り、できるだけ早くcoolingが始められなければならないことを意味しています。
新しいcooling機器の多くは急速な冷却能力を持っています。体表を効率的にcoolingする機器と高流量かつ急速な冷たい輸液が併用されれば、 4℃/hrのcooling rateを達成することができます。中枢温の“オーバーシュート(すなわち、目標体温よりも有意に低い体温にまで低下する)”を防ぐため、中枢温が正しく 測定されることが重要で、体温測定に選ばれた部位ができるだけ“真の中枢温”を反映している必要があります。“真の中枢温”として一般に認められている gold standardは、肺動脈カテーテルで測定される血液温です。
他の部位で測定される体温は、このgold standardと比較される必要があります。この点に関して、現在使われている体温測定部位及び測定方法には、共通する問題と固有の限界があるということを理解していなければなりません。患者さんの中枢温に急激な変化が見られる場合、gold standardである血液温と臨床でしばしば使われる測定部位(食道、膀胱、直腸、鼓膜)で得られる温度との間で、substantial time lags(大きな時間的な遅れ)が発生することがあります。cooling速度が早いほど、測定体温と実際の中枢温との間のtime lag(時間的な遅れ)が大きくなります。この現象は、体温のオーバーシュート(=希望の体温よりも低下する)の危険性とも大きな関係があります。測定体温には、実際の体温とは常に時間的な遅れがあります。体温が既に目標体温になっていても、その事実が体温プローブを制御している機器に正しく“インプット”されないため、cooling機器は患者さんをcoolingし続けます。cooling機器は、測定温のインプットが設定目標体温に近づくまでcoolingを続けます。この間、実際の中枢温(=血液での測定体温)は、目標体温レンジから有意に低下することがあります。
体温測定におけるこの遅れには、いくつかの理由があります。第一は、体温が低下した場合、体の様々な部位や臓器で同じ体温になるには時間がかかるということです。体温が平衡に達する速度は、臓器血流に左右されます。臓器への血液循環は、ショックや低体温といった一般的なファクタと共に、臓器固有のファクタによっても影響を受けます。また使用しているcooling機器によっても、体温測定値に影響が見られます。
現在使われている殆どの中枢温測定プローブは、体温の急速な変化を検出できるようには作られていません。むしろ(通常は長い時間をかけて起こる)小さな体 温変化をできるだけ正確に反映するようになっています。このため、これらのプローブでは、変化した体温と同じになり、機器に変化した体温をインプットする には、ある程度の時間がかかります。
この問題は、他の要因と複合して作用します。例えば、最もよく使われている膀胱温プローブ(Tyco Healthcare社製フォーリーカテーテル)は浮動する温度プローブで、カテーテル内に埋め込まれていません。このため、プローブがカテーテル内を前 後に動き、膀胱を塞ぐバルーン(生食が充填される)内に入る可能性があります。バルーンに室温の生理食塩水が充填されたばかりであった場合、温度測定に有 意な影響を与えます。勿論、時間が経てばバルーン内の生理食塩水は膀胱温に達します。温度が平衡状態になるまでには時間がかかり、その間は体温測定にエ ラーが見られ、cooling時に問題を起こします。
(この場合、温度センサが生理食塩水で満たされたバルーン内に入ったことによって、体温が過小評価さ れ、冷却速度がかなり遅くなります。)
現在、最もよく使われる温度測定部位には、それぞれの利点と問題があります。様々な中枢温測定部位と血液温との平均的な時間的な遅れ、及び様々な中枢温測定部位の利点と限界については、追加の一覧にまとめています。
低体温の副作用のリスク、特に不整脈のリスクは、患者さんの中枢温が30℃以下に低下した場合に有意に上昇します。中枢温の測定エラー(=測定遅れ)によって起きたオーバーシュートは、重篤な結果をもたらします。低体温療法をしている、あるいは急速なcore coolingをしようとしている医師は、さまざまな測定部位及び測定方法の限界について知っており、30℃以下に体温が低下しないように適切な注意を払わなければなりません。
Arctic Circle 『体温測定部位について:テクニカルな及び測定における諸問題(2)』
 まとめ
まとめ
現在使われている体温測定部位及び測定方法は、すべて、共通する問題及び特定の限界があります。殆どの温度プローブは“真の”中枢温を反映するにはかなりの時間的な遅れが見られます。低体温療法においては、特にその(急速)導入期においては、この点を考慮に入れておかなければなりません。低体温療法時はどの段階においても、中枢温を連続モニタリングする必要があります。体温測定部位の選択は個々の患者さんの置かれている状況及び医師の選択にかかっています。一般的なファクタ(例:ショック、循環のミスマッチ、敗血症、心不全など)と共に様々な個別のファクタによっても、体温測定に影響が見られます。但し、どのような状況にあっても、末梢体温は低体温療法での体温制御には使ってはなりません。
Arctic Circle 『体温測定部位について:テクニカルな及び測定における諸問題(3)』
| 部位 | 測定精度のレベル | 測定部位とgold standardとの平均遅れ時間 | 利点、問題、限界 |
| 肺動脈 | High | N/A Cooling機器との併用不可 |
|
| 食道 | High | 5分 (3~10分) |
|
| 膀胱 | Fair/High*** | 20分 (10~60分)* |
|
| 直腸 | Fair/High*** | 15分 (10~40分)** |
|
| 鼓膜 | Moderate/Fair | 10分 (5~25分) Cooling機器との併用不可 |
|
| 腋窩、鼠径部、他の末梢部位 | まったく不正確 | Gold standard との関連なし |
|
Kees Polderman先生提供
* Severe shock、乏尿症などの場合
** Severe shockの場合
*** 体温が安定しているmaintenanceフェーズでは通常high
 利点
利点  問題点
問題点
Arctic Circle 『 Q&A 』
![]()
私たちの病院では、cooling protocolを修正し、低体温療法の急速導入にcold fluids輸液を含めています。Arctic Sunによるcoolingと輸液によるcoolingを同時に開始することはできるのでしょうか?―――Ed、New Jersey
![]()
最近の文献に、低体温療法のearly initiationのためcold fluid輸液の使用についてのエビデンスがいくつか報告されています1、2。cold fluidを2L急速輸液することで、約30分のうちに最大で1.4~1.8℃の中枢温が低下します3。 輸液の間、あるいは輸液後に他の方法による全身のcoolingが行われなかった場合、体温は直ぐに通常域に上昇します。Arctic Sunを使った全身のcoolingにより全身での均一なcoolingが可能です。 cold fluidを静脈経由で輸液中にArctic Sunによるcoolingを始めた場合、体温を急速に下げることができます。Automaticモードの場合、目標体温に対して患者体温のオーバー シュートを防ぐため、Arctic Sunはcooling速度を抑えるように自動制御されます。Manualモードをcold fluid中に使用することは可能ですが、患者体温が安定した時にはAutomaticモードに切り替えるようにしてください。あるいは、患者体温が安定 するまでAutomaticモードでのcoolingを20~30分遅らせてください。このことによって、Arctic Sunの制御アルゴリズムが殆どのfluidが輸液された後の正確な体温を決定することができます。
1 Bernard S, et al. Induced hypothermia using large volume, ice-cold intravenous fluid in comatose survivors of out-ofhospital cardiac arrest: a preliminary report. Resuscitation 2003; 56:9-13
2 Polderman KH, et al. Induction of hypothermia in patients with various types of neurologic injury with use of large volumes of ice-cold intravenous fluid. Crit Care Med 2005; 33:2744-2751
3 Kim F, et al. Pilot randomized clinical trail of prehospital induction of mild hypothermia in out-of-hospital cardiac arrest patients with a rapid infusion of 4℃ normal saline. Circulation 2007; 115:3064-3070
Arctic Circle 『 Product Update 』
Arctic Sunの新機能をご紹介します。ご使用になっているArctic Sunに新しいソフトウェアを追加することで、以下の新機能をご利用頂けます。
- 体温レンジが32~38.5℃と広がりました。
― 低体温療法時により低く安全な体温を求める先生方へ
― (33℃以下の目標体温時に) 食道温の測定を必要とされる先生方へ
― 難治性発熱患者さんあるいは敗血症患者さんの治療に - 手動モードをOffにできます。
- 目標体温の設定変更がより早くできるようになりました。
- 意図しない電源停止時にパラメータと設定のチェックを警告します。
- CE/MEの方向けにキャリブレーション機能が強化されました。
- 使用頻度の少ないパラメータは、詳細設定メニューに移動しました。
- カスタムメニューへのアクセスをより簡便にしました。
Arctic Circle 『 最新文献情報 』
Simosa H, et al.
Increased Risk of Deep Venous Thrombosis After Endovascular Cooling in Patients with Traumatic Head Injury.
American Surgeon 2007; 73: 461-464
Badjatia N, et al.
Predictors and Clinical Implications of Shivering During Therapeutic Normothermia.
Neurocritical Care 2007; 6: 186-191
Badjatia N, et al.
Therapeutic Temperature Modulation in Neurocritical Care.
Neurocritical Care 2007; 6: 186-191
Fernandez A, et al.
Fever After Subarachnoid Hemorrhage, Risk Factors and Impact on Outcome.
Neurology 2007; 68: 1013-1019
Jordan JD, Carhuapoma JR.
Hypothermia: Comparing Technology.
J of the Neurol Sciences. 2007; Article in press. doi10.1016/j.jns20007.04.029
Kliegel A, et al.
Cold Infusions Alone are Effective for Induction of Therapeutic Hypothermia but Do Not Keep Patients Cool After Cardiac Arrest.
Resuscitation 2007; 73: 46-53
Kim F, et al.
Pilot Randomized Clinical Trial of Prehospital Induction of Mild Hypothermia in Out-of- Hospital Cardiac Arrest Patients with a Rapid Infusion of 4℃ Normal Saline.
Circulation 2007; 115: 3064-3070
Pyle K, Pierson G, Lepman D, Hewett M.
Keeping Cardiac Arrest Patients Alive with Therapeutic Hypothermia: How to Develop a Successful Protocol.
American Nurse Today 2007; 2: 32-37
- カテゴリ
- 学会展示会レポート
- 商品レビュー
- ユーザーの声
- イベントスケジュール
- 保守点検技術講習会
- 学会展示会・セミナー
- 特設コーナー
- 人工呼吸器PAL(仲間たち)
- 体温管理 UpToDate
- アンブ蘇生バッグ
- 赤外観察カメラpde-neo
- Respiratory Products
- Technical & Safety Tips
- シミュレーション・ラボ
- 海外レポート
- 特別企画
- インテリジェンスサービス
- 保守点検マニュアル更新のご案内
- セミナーDVD・ハンドブック等
- 呼吸回路図・呼吸回路組立
- 文献・抄録情報
- 医療機器関連書籍のご紹介
- 商品に関する資料のご請求
- その他
- メールマガジンのご登録
- メールマガジンのお問合せ
- intへのお問合わせ
- サイトマップ
- 会員制サイト
- Neuro モニタリング倶楽部
- RTXの広場 [ 休止中 ]
- 会社情報
- アイ・エム・アイ